Mehr Wellenlängen – mehr Erkenntnis
In der Biophotonik geht der Trend zur multimodalen Bildgebung und zu Plattformen, die Zellen ihre Geheimnisse mit variablen Wellenlängen und Verfahren entlocken.
Wo hört der Tumor auf? Und wo fängt das gesunde Gewebe an? Um diese Frage während chirurgischer Eingriffe klären zu können, treibt das EU-Forschungsprojekt CARMEN unter Beteiligung des Laser Zentrums Hannover (LZH) und des belgischen Innovationszentrums MULTITEL ein neuartiges, multimodales Bildgebungssystem voran. Sein Kernstück ist eine durchstimmbare, faserbasierte Ultrakurzpuls-Strahlquelle, die wahlweise Femto- oder Piko-Sekundenpulse in verschiedenen Lichtwellenlängen abgibt. So macht das kompakte Gerät Gewebeanalysen per Anti-Stokes Raman-Spektroskopie (CARS), per Multiphotonen- und per STED-(Stimulated Emission Depletion)-Mikroskopie möglich. OP-Teams könnten Biopsien je nach Bedarf mit allen drei Verfahren analysieren oder diese kombinieren, um die enthaltenen Zellen präzise zu bestimmen. Zudem eignet sich die multimodale Bildgebung laut LZH zum Nachverfolgen von Arzneien in Zellen und Gewebe oder auch zur mikroskopischen Wirksamkeitsprüfung kosmetischer Produkte.
Die Plattformen kommen
Mit ihrem Ansatz liegen LZH und MULTITEL im Trend. Auf Basis miniaturisierter Hardware, fortschreitender Digitalisierung und Automatisierung verschaffen Biophotonik-Anbieter der medizinischen und naturwissenschaftlichen Forschung Zugang zu immer differenzierteren Einblicken in Zellen, Gewebe und biochemische Prozesse. Mit der Plattform SYIONS treibt auch JENOPTIK diese Entwicklung voran. Diese lässt sich dank konfigurierbarer Module für Lichtquelle, Optik, Elektronik, Sensoren und Software spezifisch auf die diagnostische oder wissenschaftliche Fragestellung zuschneiden. Dabei ist es möglich, verschiedene optische Einheiten zu kombinieren, um Proben spektral differenziert zu analysieren oder um mehr Farben und variierenden Vergrößerungen in der Bildgebung zu nutzen. Im Sinne höherer Bildgebungsraten und differenzierter Aufzeichnung sind mehrere Farb- und Monochrom-Kameras integrierbar.
Die Flexibilität dient dazu, Proben durch multispektrale Analyse differenziertere Erkenntnisse zu entlocken. Und sie ist nötig, damit die Hardware mit der Entwicklung neuer Fluoreszenz-Farbstoffe Schritt halten kann. Weil das Farbstoffangebot von UV- bis weit in unsichtbare IR-Wellenlängen reicht, sind auch neue Lichtquellen zur Anregung sowie Sensorik zur Detektion der spezifischen Lichtemissionen gefragt. Damit können Forscherteams das volle Potenzial nutzen, um Bewegungen unterschiedlich fluoreszenz-markierter Moleküle auf Zellebene und parallel laufende Prozesse in lebenden Zellen zu verfolgen. Kurz: Sie können bislang noch verborgene Funktionen und Mechanismen entschlüsseln. Da oft schon Signale der Intensität, Lebensdauer, Konzentration oder Absorption genügen, misst die Plattform Signale, die dann wahlweise als Bild, Wärmebildkarte oder Sequenz dargestellt werden.
Eine neue Ära der Mikroskopie
Im Blog zur SYIONS-Plattform ist von einer neuen Ära der Mikroskopie die Rede: Nach dem Durchbruch der Elektronenmikroskopie, der Einführung der Antikörper-Fluoreszenzfärbung, der zunehmenden Verfahrensdifferenzierung sowie dem Durchbruch softwareunterstützter Bild- und Signalanalysen bricht eine Ära integrierter, multimodaler Plattformen an.
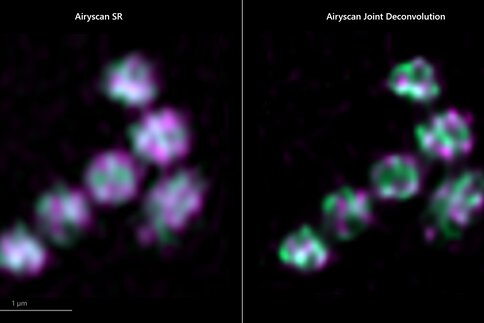
Moderne Mikroskope dienen längst nicht mehr nur der Beobachtung, sondern sind zugleich präzise Messinstrumente. Superauflösende Mikroskope wie das ZEISS Elyra 7 geben auch in lebenden Proben Einblick in Strukturen, die kaum 60 Nanometer auseinanderliegen. Bildrekonstruktionsalgorithmen sorgen in Verbindung mit strukturierter Beleuchtung dafür, dass neben der Auflösung auch die Dynamik stimmt. Bei Auflösungen weit unter 100 Nanometern zeichnet das Mikroskop bis zu 255 Bilder pro Sekunde auf. Nur so ist es möglich, biologische Prozesse in-vivo zu beobachten. Für Laser Scanning Mikroskope bietet ZEISS außerdem die Airyscan Joint Deconvolution: ein Flächendetektor mit 32 kreisförmig angeordneten Detektionselementen, die jeweils als kleine Lochblenden mit unterschiedlichen Blickwinkeln auf die Probe fungieren, liefern räumliche Informationen.
Das Anwendungsspektrum solcher Highend-Mikroskope wächst: Sei es Zellbildgebung und -detektion, mikrobielle Diagnostik, Analysen von Mikrotumoren oder die Detektion zirkulierender Tumorzell-DNA im Blut. Letztere ebnet der Krebsfrüherkennung neue Wege: Wo DNA von Tumorzellen im Blut nachweisbar ist, genügt eine Blutprobe zur präzisen Frühdiagnostik. Präzise Blutanalysen sind auch per Multi-Parameter-Durchfluss-Zytometrie machbar. Dabei fließt Blut durch eine Messzone, die von Lasern verschiedener Wellenlängen bestrahlt wird. Anhand der Fluoreszenz- und Streuungssignale, die Photomultiplier oder Avalanche-Photodioden messen, sind die im Blut enthaltenen Zellen identifizierbar. Mit fünf Lasern verschiedener Wellenlängen sind über 25 verschiedene Parameter messbar. Neue Plattformen arbeiten mit zehn Lasern von ultraviolett bis infrarot. Coherent bietet dafür die CellX-Plattform an, die diodengepumpte Festkörperlaser verschiedener Wellenlängen integriert.
Präzisere Diagnostik und personalisierte Medizin
Neben der klinischen Diagnostik liegen die wichtigsten Einsatzgebiete der Multi-Parameter-Durchfluss-Zytometrie in der Immunologie und in der Arzneimittelforschung. Die Richtung ist klar: Es geht darum, die Diagnostik so zu verfeinern, dass Krankheiten früh erkannt und mit personalisierter, engmaschig kontrollierter Behandlung geheilt werden können. Präzise Blutanalytik ist ein Schritt in diese Richtung. Doch Licht kann mehr. Dank der Photonik wächst das Verständnis von Organfunktionen und neuronalen Netzwerken auf molekularer Ebene. So kann die Optogenetik Gehirnaktivitäten anhand eingeschleuster Proteinmoleküle, die per Ultrakurzpuls-Laser schaltbar sind, verfolgen. Und zwar derart präzise, dass die Interaktion hunderter spezifisch angesteuerter Neuronen sicht- und nachvollziehbar wird.
Am Fraunhofer Institut für Lasertechnik (ILT) setzen Forscherteams Laserverfahren ein, um besonders produktive Zelllinien für die Biologika-Gewinnung zu identifizieren. Biologika sind in der Krebstherapie, zur Behandlung von Autoimmunerkrankungen und Rheuma gefragt; sie basieren auf Zellbestandteilen oder von Zellen produzierten Proteinen. Produktive Zelllinien dafür zu finden, ist komplex und kostspielig – laut ILT dauert die Suche ein Jahr und kostet rund 400 Millionen Euro. Ein ILT-Team treibt einen Ansatz voran, der dank Kombination unterschiedlicher photonischer Verfahren mit einem Viertel der Zeit auskommt: Mit markerfreier Raman-Spektroskopie identifiziert es geeignete, hochproduktive Zellkandidaten, welche es dann per LIFT- (Laser-Induced- Forward-Transfer)-Verfahren isoliert. Die weitgehend automatisierte photonische Prozesskette screent mithilfe von maschinellem Lernen schnell eine hohe Anzahl an Zelllinien. Die Raman-Spektroskopie erkennt anhand der Spektren, welche Zellen besonders viel von dem gesuchten Protein produzieren. Diese werden per LIFT in einer kleinen, per Laserpuls erzeugten Dampfblase vereinzelt, ehe das Team mit einem dritten photonischen Verfahren – der Surface Enhanced Raman Scattering (SERS) Spektroskopie – überprüft, ob tatsächlich High-Producer-Zellen ins Netz gegangen sind. Basis dafür ist eine integrierte Plattform, die UV- und MIR-Strahlquellen mit präziser optischer Hardware vereint.
Auch auf die Optik kommt es an
Die präzisen Analysen setzen nicht nur den Einsatz verschiedener Laserwellenlängen und entsprechend sensible Sensorik voraus. Um beispielsweise die oft nur schwachen Emissionen von Fluoreszenzmolekülen detektieren zu können, sind hochsensible optische Filter mit maximaler Transmission erforderlich, deren Entwicklung für biophotonische Anwendungen u.a. die AHF analysentechnik AG vorantreibt. Auch die Multiphotonen-Mikroskopie, bei der auch nicht-fluoreszierende Moleküle mit mehreren Photonen angeregt werden, um ein Photon höherer Energie zu emittieren, ist nur mit Highend-Optiken machbar. Ohne Multiphotonen-Strahlenteiler und optische Filter wäre es trotz hoher Leistungsdichten der eingesetzten Ultrakurzpulslaser kaum möglich, die gewünschte Auflösung ohne Beschädigung der biologischen Proben zu erreichen.
